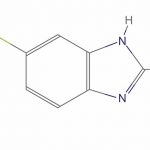
Fenbendazole oral : un antiparasitaire vétérinaire réinventé comme traitement anticancéreux
Introduction
Le fenbendazole est un médicament antiparasitaire de la famille des benzimidazoles, largement utilisé chez les chiens, bovins et autres animaux pour éliminer les parasites intestinaux. Contrairement à ses dérivés comme le mébendazole ou l’albendazole, approuvés pour un usage humain, le fenbendazole n’a pas encore reçu d’autorisation officielle de la FDA ni de l’EMA.
Pourtant, ses propriétés anticancéreuses émergent dans la recherche scientifique et soulèvent l’espoir d’un repositionnement thérapeutique. Son faible coût, sa sécurité démontrée chez l’animal et ses effets multitarget en font un candidat prometteur.
1. Contexte : de vermifuge à traitement du cancer
1.1. Mode d’action antiparasitaire
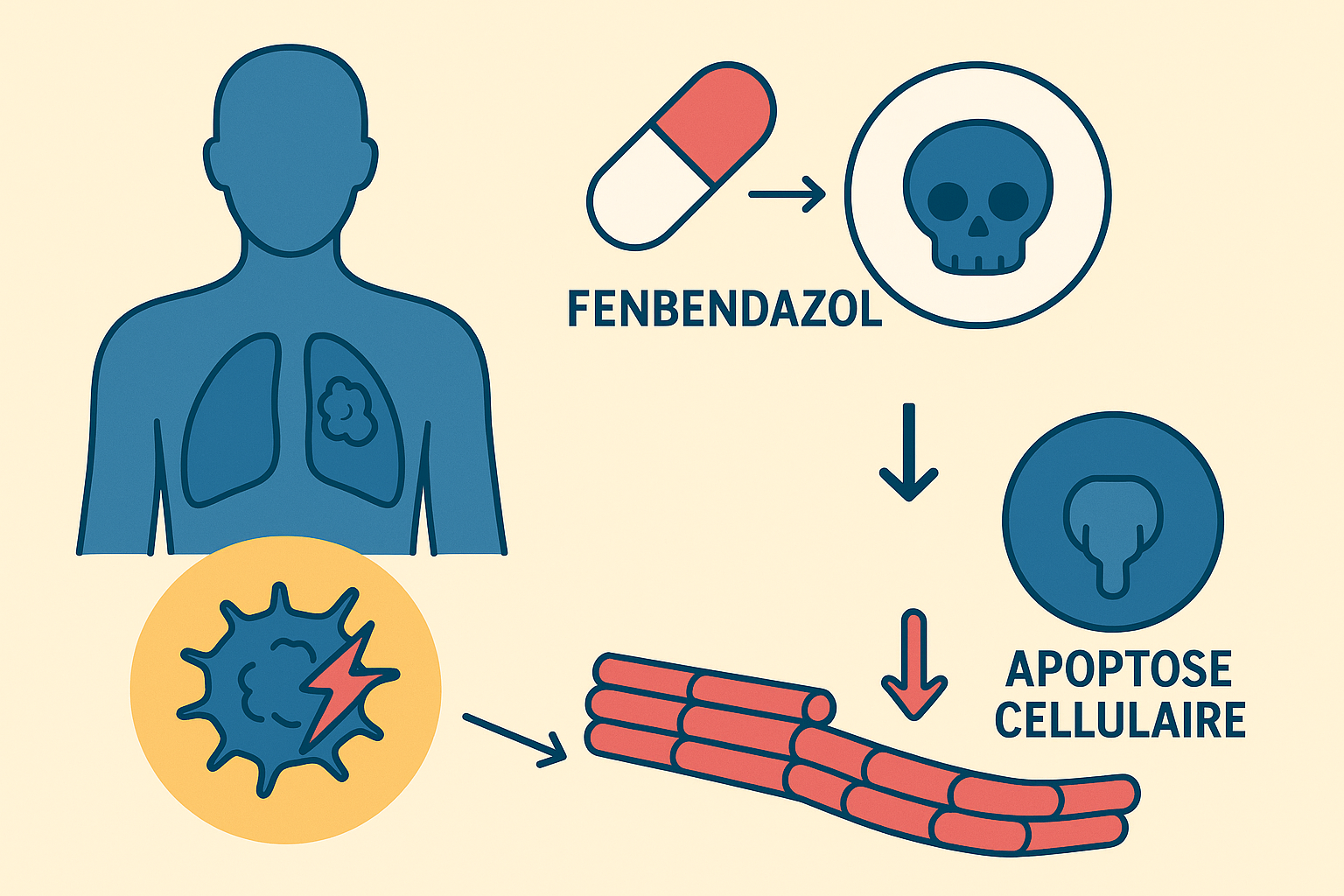
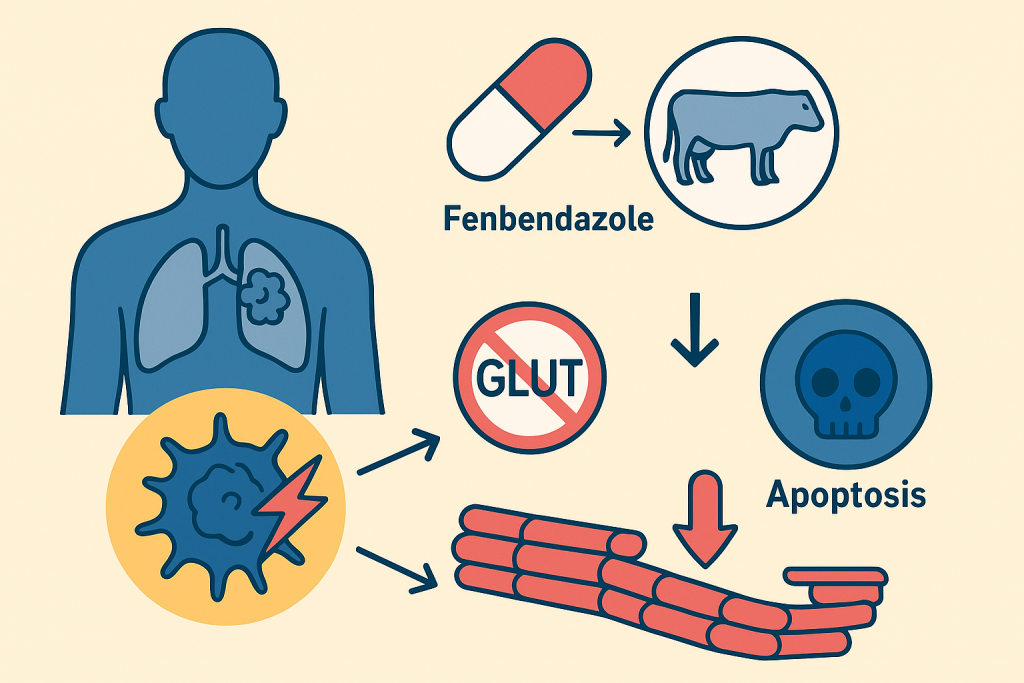
Chez l’animal, le fenbendazole agit en se liant à la β-tubuline, empêchant la polymérisation des microtubules. Cela bloque l’absorption du glucose par les parasites, ce qui les affame et entraîne leur élimination. Il en va de même pour les cellules cancéreuses d’où un engouement pour ce remède détourné de son usage premier.
En 2016, l’Américain Joe Tippens, atteint d’un cancer du poumon à petites cellules, s’est auto-administré du fenbendazole (222 mg/jour), associé à de la vitamine E, de l’huile de CBD et de la curcumine.
Après trois mois, ses examens n’ont révélé aucune cellule cancéreuse. Bien que ce témoignage reste anecdotique, il a déclenché un engouement mondial pour le fenbendazole comme traitement potentiel du cancer.
2. Mécanismes anticancéreux du fenbendazole
2.1. Inhibition de la glycolyse
Le cancer exploite une glycolyse aérobie exacerbée (effet Warburg) pour croître rapidement. Le fenbendazole :
- bloque le transporteur GLUT1, réduisant l’entrée du glucose,
- inhibe l’hexokinase II (HKII), enzyme clé de la glycolyse,
- diminue la production de lactate, limitant l’acidification du microenvironnement tumoral et la résistance aux chimiothérapies.
2.2. Activation de p53 et apoptose
Le fenbendazole active la voie p53-p21, déclenchant l’apoptose, l’autophagie et la ferroptose dans les cellules cancéreuses. Dans certains cancers résistants au 5-FU, il induit l’apoptose indépendamment de p53, ce qui le rend efficace contre des formes tumorales réfractaires.
2.3. Déstabilisation des microtubules
Comme la vincristine ou le paclitaxel, le fenbendazole agit sur les microtubules. Mais au lieu de les stabiliser, il les déstabilise, provoquant un arrêt du cycle cellulaire en phase G2/M et la mort des cellules tumorales.
2.4. Stress oxydatif
Le fenbendazole génère un stress oxydatif, active la voie MEK3/6-p38 MAPK et inhibe la prolifération tumorale, tout en épargnant les cellules normales.
3. Pharmacocinétique et limites
3.1. Métabolisme
Après administration orale, le fenbendazole est rapidement transformé en :
- oxfendazole (sulfoxyde), son métabolite actif,
- hydroxyfenbendazole et sulfone, éliminés surtout dans les fèces.
Chez le rat, la concentration plasmatique maximale reste très faible (0,32 μg/ml), confirmant sa faible biodisponibilité.
3.2. L’apport de l’oxfendazole
L’oxfendazole a déjà été testé dans un essai clinique de phase I sur 70 volontaires sains, avec une bonne tolérance (Méndez et al., 2022). Ces données offrent un aperçu de la sécurité potentielle du fenbendazole chez l’homme.
4. Amélioration de la solubilité et biodisponibilité
Le défi majeur du fenbendazole est sa faible solubilité dans l’eau (0,3 μg/ml). Plusieurs solutions ont été étudiées :
- Formulations à base de DMSO ou DNTC : prolongent la présence du médicament en inhibant les enzymes métabolisantes (CYP450).
- Complexes avec la méthyl-β-cyclodextrine : augmentent la solubilité à 20 mg/ml, soit 60 000 fois plus que la molécule pure.
- Association avec l’acide salicylique : accélère la libération du médicament (100 % en 1h).
Ces approches pourraient transformer le fenbendazole en traitement oral systémique viable.
5. Sécurité, toxicité et cas cliniques humains
5.1. Données animales
- DL50 > 10 g/kg chez le rat (très sécuritaire).
- Bien toléré chez les bovins, même à six fois la dose recommandée.
- Pas d’effet tératogène ni cancérigène observé.
5.2. Données humaines
Quelques cas d’auto-administration rapportés :
- Quatre patients ont vu une réduction tumorale (54–55).
- Deux patients ont présenté une hépatotoxicité réversible (56–57).
Le schéma le plus utilisé : 1 g/jour, 3 jours consécutifs, puis 4 jours de pause. Toutefois, ces données reposent uniquement sur des cas isolés et non sur des essais cliniques contrôlés.
6. Perspectives cliniques et associations thérapeutiques
Le fenbendazole pourrait être :
- combiné avec des inhibiteurs de la glycolyse,
- associé à des nutraceutiques (curcumine, vitamine E, CBD),
- utilisé avec des agents hépatoprotecteurs pour réduire le risque d’hépatotoxicité.
Ces stratégies pourraient améliorer son efficacité tout en limitant ses effets secondaires.
Conclusion : un candidat à ne pas négliger
Le fenbendazole incarne un exemple frappant de repositionnement médicamenteux : d’un vermifuge vétérinaire à un candidat anticancéreux prometteur. Ses mécanismes d’action multiples (glycolyse, microtubules, apoptose, stress oxydatif) ciblent efficacement les cellules tumorales, y compris celles résistantes aux traitements conventionnels.
Ses limites actuelles – faible biodisponibilité et absence d’essais cliniques humains de grande ampleur – doivent être levées par des études rigoureuses. Si ces recherches confirment son efficacité, le fenbendazole pourrait devenir une thérapie orale, peu coûteuse, accessible et complémentaire en oncologie.
Cliquez ci dessous pour découvrir un fournisseur de qualité vérifiée
Références
- Moser W ,Schindler C ,Keiser J
: Combinaisons de médicaments contre les infections par les géohelminthes . Dans : Progrès en parasitologie . Academic Press , pp. 91 – 115 , 2019 .Google Scholar- Jasmer DP ,YaoC ,Rehman A ,Johnson S
: Effets létaux multiples induits par un anthelminthique benzimidazole dans l’intestin antérieur du nématode Haemonchus contortus . Mol Biochem Parasitol 105 ( 1 ): 81 – 90 , 2000 . DOI: 10.1016/S0166-6851(99)00169-3 CrossRefPubMedGoogle Scholar- Un homme d’Edmond affirme qu’un médicament bon marché pour chiens a guéri son cancer . Oklahoma, États-Unis , Koco News , 2019. Disponible sur : https://www.koco.com/article/edmond-man-says-cheap-drug-for-dogs-cured-his-cancer/27276538 [ Dernière consultation : 29 juin 2024 ]Google Scholar
- Dogra N ,Kumar A ,Mukhopadhyay T
: Le fenbendazole agit comme un agent déstabilisant modéré des microtubules et provoque la mort des cellules cancéreuses en modulant plusieurs voies cellulaires . Sci Rep 8 ( 1 ): 11926 , 2018 . DOI: 10.1038/s41598-018-30158-6 CrossRefPubMedGoogle Scholar- Parc D ,Lee JH ,Yoon SP
: Effets anticancéreux du fenbendazole sur les cellules cancéreuses colorectales résistantes au 5-fluorouracile . Korean J Physiol Pharmacol 26 ( 5 ): 377-387 , 2022 . DOI: 10.4196/kjpp.2022.26.5.377 CrossRefPubMedGoogle Scholar- KalantarMotamedi Y ,Ejeian F ,Sabouhi F ,Bahmani L ,Nejati AS ,Bhagwat AM ,Ahadi AM ,Tafreshi AP ,Nasr-Isfahani MH ,Bender A
: Repositionnement transcriptionnel des médicaments et approche chimioinformatique pour la thérapie de différenciation des cellules leucémiques . Sci Rep 11 ( 1 ): 12537 , 2021 . DOI: 10.1038/s41598-021-91629-x CrossRefPubMedGoogle Scholar- Parc D
: Le fenbendazole inhibe la croissance et induit l’apoptose des cellules du carcinome hépatocellulaire H4IIE en croissance active via l’arrêt du cycle cellulaire médié par p21 . Biol Pharm Bull 45 ( 2 ): 184 – 193 , 2022 . DOI : 10.1248/bpb.b21-00697 CrossRefPubMedGoogle Scholar- Chang CS ,Ryu JY ,Choi JK ,Cho YJ ,Choi JJ ,Hwang JR ,Choi JY ,Noh JJ ,Lee CM ,Won JE ,Han HD ,Lee JW
: Effet anticancéreux des nanoparticules de PLGA contenant du fenbendazole dans le cancer de l’ovaire . J Gynecol Oncol 34 ( 5 ): e58 , 2023 . DOI: 10.3802/jgo.2023.34.e58 CrossRefPubMedGoogle Scholar- Duan Q ,Liu Y ,Booth CJ ,Rockwell S
: Utilisation de régimes thérapeutiques contenant du fenbendazole pour les souris dans des études expérimentales de thérapie contre le cancer . J Am Assoc Lab Anim Sci 51 ( 2 ): 224 – 230 , 2012 .PubMedGoogle Scholar- Jang J ,Poireau ,Koh B
Étude des anthelminthiques benzimidazole comme agents anticancéreux oraux . Bull Korean Chem Soc 43 ( 5 ) : 750-756 , 2022 . DOI : 10.1002 /bkcs.12519 CrossRefGoogle Scholar- Ding Y ,Zhang Z ,Ding C ,Xu S ,Xu Z
: Préparation et évaluation de complexes d’inclusion de fenbendazole méthyl-β-cyclodextrine . BMC Vet Res 20 ( 1 ): 214 , 2024 . DOI: 10.1186/s12917-024-04056-1 CrossRefPubMedGoogle Scholar- Priyanka KB ,Ramya TS ,Swarnalatha K ,Sushmitha G ,Ara A ,Srujana TS ,Swapna B
: Cocristaux de fenbendazole avec des performances de dissolution in vitro améliorées . Eur Chem Bull 12 ( 8 ): 9056 – 9061 , 2023 . DOI: 10.31838/ecb/2023.12.Si8.826 CrossRefGoogle Scholar- Phan LM ,Yeung SC ,Lee MH
Reprogrammation métabolique du cancer : importance, principales caractéristiques et potentiel pour des thérapies anticancéreuses ciblées . Cancer Biol Med 11 ( 1 ): 1 – 19 , 2014 . DOI : 10.7497/j.issn.2095-3941.2014.01.001 Google Scholar- Seyfried TN ,Flores RE ,Poff AM ,D’Agostino DP
: Le cancer comme maladie métabolique : implications pour de nouvelles thérapies . Carcinogenesis 35 ( 3 ) : 515-527 , 2014 . DOI : 10.1093/carcin/bgt480 CrossRefPubMedGoogle Scholar- Reinfeld BI ,Madden MZ ,Loup MM ,Chytil A ,Bader JE ,Patterson AR ,Sugiura A ,Cohen AS ,Ali A ,Faire BT ,Muir A ,Lewis, Californie ,Hongo RA ,Jeune KL ,Brun RE ,Todd VM ,Huffstater T ,Abraham A ,O’Neil RT ,Wilson MH ,Xin F ,Tantawy MN ,Joyeux homme WD ,Johnson RW ,Williams CS ,Mason EF ,Mason FM ,Beckermann KE ,Vander Heiden MG ,Manning HC ,Rathmell JC ,Rathmell WK
: Répartition cellulaire programmée des nutriments dans le microenvironnement tumoral . Nature 593 ( 7858 ) : 282-288 , 2021 . DOI : 10.1038/s41586-021-03442-1 CrossRefGoogle Scholar- Bose S ,Le A
: Métabolisme du glucose dans le cancer . Dans : L’hétérogénéité du métabolisme du cancer . Cham, Suisse , Springer , pp. 3 – 12 , 2018 .Google Scholar- Damiani C ,Colombo R ,Gaglio D ,Mastroianni F ,Pescini D ,Westerhoff HV ,Mauri G ,Vanoni M ,Alberghina L
: Un modèle métabolique fondamental élucide comment une meilleure utilisation du glucose et de la glutamine, associée à une production accrue de lactate dépendante de la glutamine, favorise la croissance des cellules cancéreuses : l’effet WarburQ . PLoS Comput Biol 13 ( 9 ): e1005758 , 2017 . DOI : 10.1371/journal.pcbi.1005758 CrossRefPubMedGoogle Scholar- Lunt SY ,Vander Heiden MG
Glycolyse aérobie : répondre aux besoins métaboliques de la prolifération cellulaire . Ann Rev Cell Dev Biol 27 ( 1 ) : 441-464 , 2011 . DOI : 10.1146/annurev-cellbio-092910-154237 CrossRefPubMedGoogle Scholar- Vander Heiden MG ,Cantley LC ,Thompson CB
: Comprendre l’ effet Warburg : les exigences métaboliques de la prolifération cellulaire . Science 324 ( 5930 ) : 1029-1033 , 2009 . DOI : 10.1126/science.1160809 Google Scholar- Pavlova NN ,Thompson CB
: Les nouvelles caractéristiques du métabolisme du cancer . Cell Metab 23 ( 1 ): 27 – 47 , 2016 . DOI: 10.1016/j.cmet.2015.12.006 CrossRefPubMedGoogle Scholar- Schiliro C ,Firestein BL
: Mécanismes de reprogrammation métabolique des cellules cancéreuses favorisant une croissance et une prolifération accrues . Cells 10 ( 5 ): 1056 , 2021 . DOI : 10.3390/cells10051056 CrossRefPubMedGoogle Scholar- ↵
- Martínez-Reyes I ,Chandel NS
: Métabolisme du cancer : perspectives d’avenir . Nat Rev Cancer 21 ( 10 ) : 669-680 , 2021 . DOI : 10.1038/s41568-021-00378-6 CrossRefPubMedGoogle Scholar
- Koh YW ,Lee SJ ,Parc SY
: Expression différentielle et signification pronostique de GLUT1 selon le type histologique de cancer du poumon non à petites cellules et son association avec les paramètres volumiques . Cancer du poumon 104 : 31-37 , 2017. DOI : 10.1016/j.lungcan.2016.12.003 CrossRefPubMedGoogle Scholar- Goodwin J ,Neugent ML ,Lee SY ,Choe JH ,Choi H ,Jenkins DMR ,Ruthenborg RJ ,Robinson MW ,Jeong JY ,Réveille-toi M ,Abe H ,Takeda N ,Endo H ,Inoue M ,Xuan Z ,Yoo H ,Chen M ,Ahn JM ,Minna JD ,Helke KL ,Singh PK , Base de données Shackelford ,Kim JW
: Le phénotype métabolique distinct du carcinome épidermoïde pulmonaire définit une vulnérabilité sélective à l’inhibition glycolytique . Nat Commun 8 : 15503 , 2017. DOI : 10.1038/ncomms15503 CrossRefPubMedGoogle Scholar- Smolle E ,Leko P ,Stacher-Priehse E ,Brcic L ,El-Heliebi A ,Hofmann L ,Quehenberger F ,Hrzenjak A ,Popper HH ,Olschewski H ,Leithner K
: Distribution et signification pronostique de la gluconéogenèse et de la glycolyse dans le cancer du poumon . Mol Oncol 14 ( 11 ): 2853-2867 , 2020 . DOI: 10.1002 /1878-0261.12780 CrossRefPubMedGoogle Scholar- Rue Sizemore ,Zhang M ,Cho JH ,Sizemore GM ,Hurwitz B ,Kaur B ,Lehman Pays-Bas ,Ostrowski MC ,Robe PA ,Miao W ,Wang Y ,Chakravarti A ,Xia F.
: La pyruvate kinase M2 régule la réparation des cassures double brin de l’ADN par recombinaison homologue . Cell Res 28 ( 11 ): 1090 – 1102 , 2018 . DOI : 10.1038/s41422-018-0086-7 CrossRefGoogle Scholar- Duan Q ,Liu Y ,Rockwell S
: Le fenbendazole comme médicament anticancéreux potentiel . Anticancer Res 33 ( 2 ): 355 – 362 , 2013 .Google Scholar- Patra KC ,Wang Q ,Bhaskar PT ,Miller L ,Wang Z ,Wheaton W ,Chandel N ,Laakso M ,Muller WJ ,Allen EL ,Jha AK ,Smolen GA ,Clasquin MF ,Robey B ,Foin N
L’ hexokinase 2 est nécessaire à l’initiation et au maintien de la tumeur, et sa suppression systémique est thérapeutique dans les modèles murins de cancer . Cancer Cell 24 ( 2 ): 213-228 , 2013 . DOI : 10.1016/j.ccr.2013.06.014 CrossRefPubMedGoogle Scholar- Čermák V ,Dostál V ,Jelínek M ,Libusová L ,Kovář J ,Rösel D ,Brábek J
: Agents ciblant les microtubules et leur impact sur le traitement du cancer . Eur J Cell Biol 99 ( 4 ): 151075 , 2020 . DOI: 10.1016/j.ejcb.2020.151075 - Dumontet C ,Jordanie MA
Agents de liaison aux microtubules : un domaine dynamique de la thérapeutique anticancéreuse . Nat Rev Drug Discov 9 ( 10 ) : 790-803 , 2010. DOI : 10.1038/ nrd3253- Coulup SK ,Georg GI
: Revue des agents de ciblage des microtubules : l’α-tubuline et le site de liaison de la pironétine comme cibles inexplorées pour les thérapies anticancéreuses . Bioorg Med Chem Lett 29 ( 15 ): 1865-1873 , 2019 . DOI : 10.1016/j.bmcl.2019.05.042- Directeur général de Higa
: Le microtubule comme cible du cancer du sein . Breast Cancer 18 ( 2 ): 103 – 119 , 2011 . DOI: 10.1007/s12282-010-0224-7- Arnst KE ,Wang Y ,Hwang DJ ,Xue Y ,Costello T ,Hamilton D ,Chen Q ,Yang J ,Parc F ,Dalton JT ,Miller DD ,Li W
Un inhibiteur de la tubuline puissant et métaboliquement stable cible le site de liaison de la colchicine et surmonte la résistance aux taxanes . Cancer Res 78 ( 1 ) : 265-277 , 2018 . DOI : 10.1158/0008-5472.CAN-17-0577 Google Scholar- Jordan M
: Mécanisme d’action des médicaments antitumoraux interagissant avec les microtubules et la tubuline . Curr Med Chem Anticancer Agents 2 ( 1 ): 1 – 17 , 2012 . DOI : 10.2174/1568011023354290 CrossRefGoogle Scholar- Mrkvová Z ,Uldrijan S ,Pombinho A ,Bartůněk P ,Slaninová I
: Les benzimidazoles régulent négativement Mdm2 et MdmX et activent p53 dans les cellules tumorales surexprimant MdmX . Molecules 24 ( 11 ): 2152 , 2019 . DOI: 10.3390/molecules24112152 - Wang L ,Xu K ,Wang N ,Ding L ,Zhao W ,Wan R ,Zhao W ,Guo X ,Pan X ,Yang J ,Roses I ,Yu G
: Le fenbendazole atténue la fibrose pulmonaire induite par la bléomycine chez la souris en supprimant la différenciation des fibroblastes en myofibroblastes . Int J Mol Sci 23 ( 22 ): 14088 , 2022 . DOI: 10.3390/ijms232214088 - Peng Y ,Pan J ,Ou F ,Wang W ,Hein ,Chen L ,Zeng S ,Zeng K ,Yu L
Le fenbendazole et son analogue synthétique interfèrent avec la prolifération et le métabolisme énergétique des cellules HeLa en induisant un stress oxydatif et en modulant la voie MEK3/6-p38-MAPK . Chem Biol Interact 361 : 109983 , 2022. DOI : 10.1016/j.cbi.2022.109983 CrossRefPubMedGoogle Scholar- Capce BP ,Virkel GL ,Lanusse CE
: Comportement énantiomérique des sulfoxydes d’albendazole et de fenbendazole chez les animaux domestiques : implications pharmacologiques . Vet J 181 ( 3 ) : 241-250 , 2009 . DOI : 10.1016/j.tvjl.2008.11.010 - Virkel G ,Lifschitz A ,Sallovitz J ,Pis A ,Lanusse C
: Sulfoxydation énantiosélective hépatique et extrahépatique comparative de l’albendazole et du fenbendazole chez les ovins et les bovins . Drug Metab Dispos 32 ( 5 ): 536-544 , 2004 . DOI : 10.1124/dmd.32.5.536 Google Scholar- Wu Z ,Lee D ,Joo J ,Shin JH ,Kang W ,Oh S ,Lee DY ,Lee SJ ,Ouais SS ,Lee HS ,Lee T ,Liu KH
: Les CYP2J2 et CYP2C19 sont les principales enzymes responsables du métabolisme de l’albendazole et du fenbendazole dans les microsomes hépatiques humains et les systèmes de dosage recombinants du P450 . Antimicrob Agents Chemother 57 ( 11 ): 5448-5456 , 2013 . DOI : 10.1128/AAC.00843-13 Google Scholar- McKellar QA ,Gokbulut C ,Muzandu K ,Benchaoui H
Pharmacocinétique, métabolisme et potentialisation du fenbendazole chez le cheval . Drug Metab Dispos 30 ( 11 ): 1230-1239 , 2002 . DOI : 10.1124 /dmd.30.11.1230 Google Scholar- Fenbendazole . Organisation des Nations Unies pour l’alimentation et l’agriculture . Disponible à l’adresse : https://www.fao.org/fileadmin/user_upload/vetdrug/docs/41-4-fenbendazole.pdf [ Dernière consultation : 29 juin 2024 ]Google Scholar
- Bach T , DJ Murray ,Stebounova LV ,Deye G ,Winokur P ,Un G
Modèle pharmacocinétique de population de l’oxfendazole et de ses métabolites chez des adultes sains après administration de doses uniques croissantes . Antimicrob Agents Chemother 65 ( 4 ) : e02129-20 , 2021 . DOI : 10.1128/AAC.02129-20 Google Scholar- Gottschall DW ,Théodorides VJ ,Wang R
: Le métabolisme des anthelminthiques benzimidazole. Parasitology today , pp. 115 – 124 , 1990 .Google Scholar- Oxfendazole . Organisation des Nations Unies pour l’alimentation et l’agriculture . Disponible à l’adresse : https://www.fao.org/fileadmin/user_upload/vetdrug/docs/41-4-oxfendazole.pdf [ Dernière consultation : 29 juin 2024 ]Google Scholar
- CR court ,Barker SA ,Hsieh LC ,Ou SP ,McDowell T ,Davis LE ,Neff-Davis CA ,Koritz G ,Bevill RF ,Munsiff IJ
: Disposition du fenbendazole chez les bovins . Am J Vet Res 48 ( 6 ): 958 – 961 , 1987 .- Muser RK ,Paul JW
: Sécurité de l’utilisation du fenbendazole chez les bovins . Mod Vet Pract 65 ( 5 ): 371 – 374 , 1984 .- Villar D ,Cray C ,Zaias J ,Altman NH
: Effets biologiques du fenbendazole chez le rat et la souris : une revue . J Am Assoc Lab Anim Sci 46 ( 6 ): 8 – 15 , 2007 .- Un G , DJ Murray ,Gajurel K ,Bach T ,Deye G ,Stebounova LV ,Codd EE ,Horton J ,Gonzalez AE ,Garcia HH ,Ince D ,Hodgson-Zingman D ,Nomicos EYH ,Conrad T ,Kennedy J ,Jones W ,Gilman RH ,Winokur P
Pharmacocinétique, sécurité et tolérance de l’oxfendazole chez des volontaires sains : une première étude randomisée, contrôlée par placebo et à dose unique, chez l’humain . Antimicrob Agents Chemother 63 ( 4 ) : e02255-18 , 2019. DOI : 10.1128/AAC.02255-18 - Gokbulut C ,Biligili A ,Hanedan B ,McKellar QA
: Disposition plasmatique comparative du fenbendazole, de l’oxfendazole et de l’albendazole chez le chien . Vet Parasitol 148 ( 3-4 ) : 279-287 , 2007 . DOI: 10.1016/j.vetpar.2007.06.028 - Hickman D ,Wang JP ,Wang Y ,Unadkat JD
: Evaluation de la sélectivité des sondes in vitro et de l’adéquation des solvants organiques pour la mesure des activités de la monooxygénase du cytochrome p450 humain . Drug Metab Dispos 26 ( 3 ): 207 – 215 , 1998 .- Easterbrook J ,Lu C ,Sakai Y ,Li AP
: Effets des solvants organiques sur les activités des isoformes du cytochrome p450, de la glucuronyl transférase dépendante de l’udp et de la phénol sulfotransférase dans les hépatocytes humains . Drug Metab Dispos 29 ( 2 ): 141 – 144 , 2001 .- Chung I ,Zhou K ,Brouettes C ,Banyard J ,Wilson A ,Rummel N ,Mizokami A ,Basu S ,Sengupta P ,Cheikh B ,Sengupta S ,Bielenberg DR ,Zetter BR
Un dépistage phénotypique impartial identifie des agents thérapeutiques sélectifs pour le cancer métastatique de la prostate . Front Oncol 10 : 594141 , 2021. DOI : 10.3389/fonc.2020.594141 - Abughanimeh O ,Evans T ,Kallam A
: Le fenbendazole comme traitement du lymphome diffus à grandes cellules B. Ann Hematol Oncol 7 ( 2 ): 1284 , 2020 .- Chiang RS ,Syed AB ,Wright JL ,Montgomery B ,Srinivas S
: Effet antitumoral renforcé par le fenbendazole : une série de cas . Clin Oncol Case Rep 4 ( 2 ), 2021 .- Yamaguchi T ,Shimizu J ,Oya Y ,Horio Y ,Hida T
Lésion hépatique d’origine médicamenteuse chez un patient atteint d’un cancer du poumon non à petites cellules après auto-administration de fenbendazole, d’après des informations diffusées sur les réseaux sociaux . Case Rep Oncol 14 ( 2 ) : 886-891 , 2021 . DOI: 10.1159/000516276 - Thakurdesai A ,Rivera-Matos L ,Nagra N ,Busch B ,Mais DD ,Cave MC
: Lésion hépatique grave d’origine médicamenteuse due à l’auto-administration du fenbendazole, un médicament vétérinaire anthelminthique . ACG Case Rep J 11 ( 5 ): e01354 , 2024 . DOI: 10.14309/crj.0000000000001354 - Dogra N ,Mukhopadhyay T
: L’altération de la voie ubiquitine-protéasome par le méthyl N-(6-phénylsulfanyl-1H-benzimidazol-2-yl)carbamate entraîne un puissant effet cytotoxique sur les cellules tumorales : un nouvel agent antiprolifératif aux implications thérapeutiques potentielles . J Biol Chem 287 ( 36 ): 30625 – 30640 , 2012 . DOI : 10.1074/jbc.M111.324228 - Gao P ,Zut CV ,Watson J
: Effet antitumorigène inattendu du fenbendazole lorsqu’il est associé à des vitamines supplémentaires . J Am Assoc Lab Anim Sci 47 ( 6 ): 37 – 40 , 2008 .- Jin est ,Jo MJ ,Parc CW ,Chung YB ,Kim JS ,Shin DH
Évaluation physicochimique, pharmacocinétique et de la toxicité des micelles polymères Soluplus(®) encapsulant du fenbendazole . Pharmaceutics 12 ( 10 ) : 1000 , 2020 . DOI : 10.3390/pharmaceutics12101000