Energie Vitalité Santé Naturellement
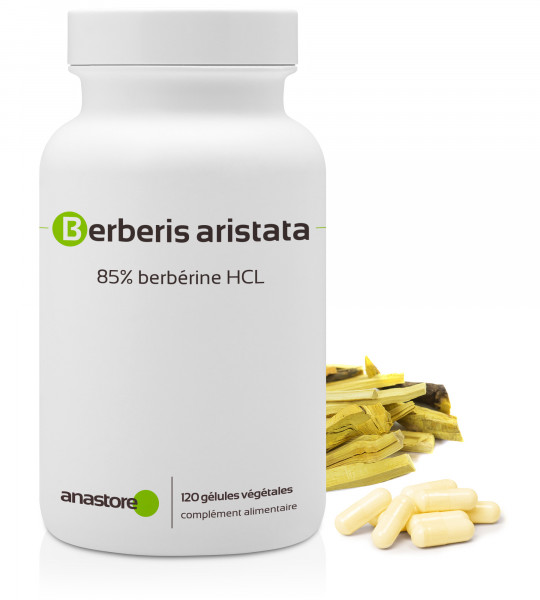
La Berbérine ou Berberis aristata
Posted on décembre 31, 2025 by BienEtreNaturel

Berbérine (Berberis aristata) : bienfaits pour la santé et potentiel anticancer étudié par la science
Introduction
La berbérine, un composé naturel extrait notamment de Berberis aristata, suscite un intérêt croissant dans le domaine de la santé naturelle et de la recherche scientifique.
Utilisée depuis des siècles en médecine ayurvédique et chinoise, elle est aujourd’hui étudiée pour ses effets sur la glycémie, le métabolisme, l’inflammation, mais aussi pour son potentiel anticancéreux observé dans de nombreuses études précliniques.
Dans cet article, nous explorons les bienfaits reconnus de la berbérine, ses mécanismes d’action biologiques, les résultats scientifiques concernant le cancer, ainsi que les précautions essentielles à connaître avant toute utilisation.
Qu’est-ce que la berbérine et Berberis aristata ?
La berbérine est un alcaloïde isoquinoléique présent dans plusieurs plantes, dont Berberis aristata, Berberis vulgaris et Coptis chinensis. C’est elle qui confère à ces plantes leurs propriétés médicinales caractéristiques.
Traditionnellement, Berberis aristata est utilisée pour :
- soutenir la digestion,
- lutter contre les infections,
- favoriser l’équilibre métabolique,
- apaiser les inflammations chroniques.
Aujourd’hui, la berbérine est disponible sous forme de complément alimentaire standardisé, permettant un dosage plus précis.
Les principaux bienfaits de la berbérine pour la santé
Régulation de la glycémie et du métabolisme
La berbérine est largement étudiée pour son action sur :
- la réduction de la glycémie à jeun,
- l’amélioration de la sensibilité à l’insuline,
- la baisse des triglycérides et du LDL-cholestérol.
Son mécanisme repose notamment sur l’activation de l’enzyme AMPK, parfois qualifiée de « chef d’orchestre du métabolisme énergétique ».
Pour cette raison, la berbérine est souvent comparée à certains traitements antidiabétiques, bien qu’elle reste un complément et non un médicament. La Berbérine est souvent associée à la Curcumine extraite du curcuma.
Santé cardiovasculaire
Grâce à ses effets sur le métabolisme lipidique et l’inflammation, la berbérine peut contribuer à :
- réduire les facteurs de risque cardiovasculaire,
- améliorer la fonction endothéliale,
- limiter le stress oxydatif au niveau vasculaire.
Ces propriétés en font un allié potentiel dans la prévention métabolique globale.
Effets anti-inflammatoires et antioxydants
L’inflammation chronique de bas grade est impliquée dans de nombreuses pathologies modernes, dont le cancer.
La berbérine agit en modulant plusieurs voies inflammatoires majeures, notamment :
- NF-κB,
- cytokines pro-inflammatoires,
- production excessive de radicaux libres.
Ces effets expliquent son intérêt dans une approche préventive et intégrative.
Microbiote et santé digestive
La berbérine possède également des propriétés :
- antimicrobiennes (contre certaines bactéries et parasites),
- régulatrices du microbiote intestinal.
Or, l’équilibre du microbiote est aujourd’hui reconnu comme un facteur clé dans :
- l’immunité,
- l’inflammation,
- la réponse aux traitements anticancéreux.
Berbérine et cancer : que montre la recherche scientifique ?
Un potentiel anticancéreux largement étudié en laboratoire
De nombreuses études in vitro (cellules) et in vivo (animaux) ont mis en évidence que la berbérine peut :
- inhiber la prolifération des cellules cancéreuses,
- induire l’apoptose (mort programmée),
- bloquer certaines phases du cycle cellulaire,
- réduire l’angiogenèse tumorale,
- limiter la migration et l’invasion métastatique.
Ces effets ont été observés dans différents types de cancers, notamment :
- cancer du sein,
- cancer colorectal,
- cancer du foie,
- cancer du poumon,
- cancer de la prostate.
Mécanismes biologiques impliqués
La berbérine agit sur plusieurs voies de signalisation clés du cancer, parmi lesquelles :
- PI3K/Akt/mTOR,
- MAPK,
- STAT3,
- NF-κB,
- régulation des gènes pro-apoptotiques et anti-apoptotiques.
Elle influence également le stress oxydatif mitochondrial et le métabolisme énergétique des cellules tumorales, un point qui rejoint certaines hypothèses métaboliques du cancer.
Synergie potentielle avec les traitements conventionnels
Certaines études suggèrent que la berbérine pourrait :
- sensibiliser les cellules cancéreuses à la chimiothérapie,
- réduire certains phénomènes de chimiorésistance,
- limiter les dommages oxydatifs induits par les traitements.
Ces résultats restent précliniques et ne constituent pas une recommandation thérapeutique autonome.
Limites scientifiques et précautions essentielles
Il est fondamental de rappeler que :
- la berbérine n’est pas un traitement anticancéreux validé cliniquement,
- la majorité des données provient d’études expérimentales,
- les essais cliniques chez l’humain restent limités.
Effets secondaires possibles
- troubles digestifs (diarrhée, crampes),
- hypotension ou hypoglycémie,
- interactions médicamenteuses (antidiabétiques, anticoagulants, chimiothérapie).
❗ La berbérine ne doit jamais remplacer un traitement médical, et son usage doit être discuté avec un professionnel de santé, en particulier en contexte de cancer.
Conclusion : une molécule prometteuse à utiliser avec discernement
La berbérine issue de Berberis aristata est une molécule naturelle aux nombreux bienfaits documentés, notamment sur le métabolisme, l’inflammation et l’immunité.
Son potentiel anticancéreux, bien que prometteur, reste en cours d’évaluation scientifique.
Elle s’inscrit avant tout dans une approche complémentaire et intégrative, axée sur le terrain métabolique et inflammatoire, et non comme une alternative aux traitements conventionnels.
Action berbérine
Vous vous intéressez aux approches naturelles complémentaires en oncologie ?
Abonnez-vous à notre newsletter pour recevoir :
- des analyses scientifiques accessibles,
- des articles de fond sur les compléments naturels,
- des mises à jour sur la recherche intégrative contre le cancer.
Références scientifiques
- Tillhon M. et al., Berberine: new perspectives for old remedies, Biochem Pharmacol
- Sun Y. et al., Anticancer effects of berberine, Cancer Letters
- Liu Q. et al., Berberine and cancer metabolism, Frontiers in Oncology
- PubMed ID : 35889396
- PubMed ID : 34885950
- PubMed ID : 31208348
Trouvez ci-dessous une berbérine de qualité

Rapport synthétique : synergie entre la curcumine et la berbérine
Introduction
La curcumine (extraite du Curcuma longa) et la berbérine (notamment issue de Berberis aristata) sont deux composés naturels largement étudiés pour leurs propriétés anti-inflammatoires, antioxydantes, métaboliques et anticancéreuses. De plus en plus de travaux scientifiques suggèrent que leur association pourrait produire des effets synergiques, supérieurs à ceux observés lorsqu’elles sont utilisées séparément.
Mécanismes biologiques complémentaires
La curcumine et la berbérine agissent sur des voies biologiques convergentes mais non redondantes, ce qui explique leur compatibilité :
- Inhibition de l’inflammation chronique
Les deux molécules modulent la voie NF-κB, réduisant l’expression de cytokines pro-inflammatoires impliquées dans le cancer et les maladies métaboliques. - Action sur le métabolisme énergétique
La berbérine active fortement l’enzyme AMPK, tandis que la curcumine améliore la sensibilité à l’insuline et réduit le stress oxydatif mitochondrial. Cette double action cible le métabolisme altéré des cellules cancéreuses. - Induction de l’apoptose tumorale
Des études précliniques montrent que leur combinaison favorise :- l’activation des caspases,
- l’augmentation des protéines pro-apoptotiques (Bax),
- la réduction des protéines de survie cellulaire (Bcl-2).
Intérêt potentiel en oncologie intégrative
En contexte expérimental, l’association curcumine-berbérine a montré :
- une inhibition accrue de la prolifération tumorale,
- une réduction de l’angiogenèse,
- une diminution de la migration et de l’invasion cellulaire,
- une possible sensibilisation aux chimiothérapies, réduisant certains phénomènes de résistance.
Ces effets ont été observés notamment dans des modèles de cancer du sein, colorectal et hépatique.
Biodisponibilité et optimisation
La curcumine souffre d’une faible biodisponibilité orale. Or, certaines données suggèrent que la berbérine pourrait :
- moduler les transporteurs intestinaux,
- influencer le microbiote,
- améliorer indirectement l’absorption et la stabilité métabolique de la curcumine.
Cela renforce l’intérêt de formulations combinées et bien standardisées.
Limites et précautions
- Les données disponibles sont majoritairement précliniques.
- Aucune recommandation thérapeutique officielle n’existe à ce jour.
- L’association peut interagir avec des traitements médicamenteux, notamment en oncologie.
L’usage conjoint de la curcumine et de la berbérine doit toujours s’inscrire dans une approche complémentaire, sous supervision médicale.
Conclusion
La curcumine et la berbérine présentent une synergie biologique prometteuse, reposant sur la modulation de l’inflammation, du métabolisme cellulaire et des mécanismes de survie tumorale. Leur association attire un intérêt croissant en oncologie intégrative.

Fenbendazole & cancer œsophagien et gastrique
Posted on décembre 11, 2025 by BienEtreNaturel
Fenbendazole et ivermectine contre les cancers de l’estomac et de l’œsophage : compilation de 11 cas cliniques majeurs (décembre 2025)
Les cancers de l’œsophage et de l’estomac comptent parmi les tumeurs digestives les plus agressives, avec des diagnostics souvent tardifs et des options thérapeutiques limitées. Malgré les progrès en chimiothérapie, immunothérapie ou radiothérapie, de nombreux patients voient leur pronostic réservé et se tournent vers des solutions alternatives.
Parmi ces pistes émergentes, deux molécules attirent une attention croissante : le fenbendazole et l’ivermectine, deux antiparasitaires vétérinaires qui démontrent, dans une série de témoignages récents, un potentiel anticancéreux intrigant.
Cette compilation réunit 11 cas rapportés en 2024-2025, où ces traitements repositionnés — parfois utilisés seuls, parfois associés à des compléments ou à des soins conventionnels — ont entraîné une régression tumorale, une amélioration clinique majeure ou même des rémissions complètes.
11 Cas de rémission ou d’amélioration documentés (2024-2025)
Cas 11 – Décembre 2025
Femme de 68 ans – Cancer gastrique métastatique (stade 4) – Rémission complète en 5 mois
Originaire de Virginie, cette patiente a commencé un protocole associant ivermectine, fenbendazole, CBD et curcumine.
Résultats :
- Endoscopie : plus de trace de maladie
- PET scan : absence totale d’activité cancéreuse
- Oncologue “stupéfait” par une réponse « bien supérieure à la moyenne ».
Cas 10 – Décembre 2025
Homme de 22 ans – Cancer de l’œsophage stade 4 – Rémission en 5 mois
Ce jeune Canadien a combiné ivermectine, mébendazole et huile de CBD.
Résultat : rémission complète malgré un pronostic initial défavorable.
Cas 9 – Septembre 2025
Homme de 36 ans – Adénocarcinome de l’œsophage métastasé
Dale Atkinson, diagnostiqué en phase terminale, a combiné thérapies conventionnelles et traitements métaboliques incluant des médicaments repositionnés.
Il est devenu cofondateur de Beyond the Standard, soutenant d’autres patients.
Cas 8 – Septembre 2025
Australien de 37 ans – Cancer de l’œsophage – Guérison en 2 mois
Refusant chirurgie, chimio et radiothérapie, il a suivi un protocole ivermectine + fenbendazole.
Début septembre 2025 : PET scan totalement normal.
Cas 7 – Septembre 2025
Cancer colorectal + gastrique stade 4 – Pronostic vital 12 à 19 mois → Guérison
Grâce à un protocole mêlant ivermectine, fenbendazole et bleu de méthylène, ce patient déclaré incurable en 2022 est toujours sans cancer en 2025.
Cas 6 – Juillet 2025
Homme de 74 ans – GIST de 30 cm – Réduction significative
Protocole ivermectine + mébendazole.
En 4 mois :
- Tumeur réduite de 30 cm à 23 cm
- Baisse du SUVmax
- Nécrose centrale → signes de tumeur mourante.
Cas 5 – Mai 2025
Adénocarcinome de l’œsophage stade 4 – Métastases ganglionnaires et hépatiques
Jeff Bryant, diagnostiqué début 2025, observe une amélioration notable sous FOLFOX + Opdivo, qu’il associe à un protocole métabolique.
Cas 4 – Mars 2025
Homme de 55 ans – Cancer gastrique stade 4 – Baisse de 99 % des marqueurs tumoraux
Grâce à l’ivermectine et au fenbendazole, ses marqueurs CA19-9 et ACE chutent presque à zéro.
Cas 3 – Novembre 2023 → Novembre 2024 (témoignage publié 2025)
Homme de 66 ans – Cancer de l’œsophage métastatique – Rémission confirmée
Déclaré inopérable, il combine fenbendazole, compléments et quelques traitements palliatifs.
Après 14 mois :
- Disparition complète du cancer
- Rémission confirmée à 8 mois de suivi
Cas 2 – Mars 2025
Homme de 74 ans – GIST de 28 cm – Début de régression en 1 mois
Après arrêt du Gleevec pour effets secondaires, il entame ivermectine + fenbendazole.
Résultat :
- Activité métabolique tumorale : –47 %
- Ascite résolue
- Amélioration de l’appétit et du confort digestif.
Cas 1 – Décembre 2024
Californien de 60 ans – Cancer gastrique stade 2 – Amélioration métabolique en 2 mois
Sans aucun traitement conventionnel, seulement ivermectine + fenbendazole à fortes doses.
Résultat :
- –25 % d’activité métabolique (TEP/TDM) en 60 jours.
Cas 0 (référence historique 2024)
Homme de 93 ans – Cancer de l’œsophage – Déclaré guéri en 2,5 mois
Condamné à recevoir uniquement des soins palliatifs, il prend du fenbendazole liquide.
Contrôle : rémission complète après 10 semaines.
Conclusion
Ces 11 cas illustrent des trajectoires remarquables : rémissions rapides, tumeurs régressives et améliorations métaboliques inattendues, parfois chez des patients considérés comme incurables.
Le fenbendazole et l’ivermectine semblent agir sur des mécanismes cellulaires clés impliqués dans la prolifération tumorale, mais ces observations, aussi inspirantes soient-elles, ne remplacent pas les essais cliniques contrôlés nécessaires pour valider leur efficacité et leur sécurité.
Au-delà de leurs résultats, ces témoignages racontent aussi la résilience, la curiosité scientifique et la détermination de patients prêt à explorer de nouvelles voies, ouvrant la porte à une réflexion urgente sur l’intégration de thérapies non conventionnelles dans la recherche en oncologie.
FAQ – Fenbendazole & Ivermectine pour les cancers gastriques et œsophagiens
1. Le fenbendazole peut-il aider à traiter le cancer de l’estomac ou de l’œsophage ?
Le fenbendazole fait l’objet de nombreux témoignages anecdotiques rapportant des rémissions et des améliorations cliniques. Il n’existe cependant pas d’essai clinique officiel validant son efficacité, mais des études précliniques suggèrent des effets anticancéreux potentiels.
2. Comment l’ivermectine agit-elle sur les cellules cancéreuses ?
Des travaux en laboratoire montrent que l’ivermectine pourrait perturber le métabolisme énergétique des cellules tumorales, favoriser l’apoptose (mort cellulaire) et renforcer la réponse immunitaire. Sa pertinence clinique reste à confirmer par des essais humains.
3. Le fenbendazole est-il sûr pour l’être humain ?
Ce médicament est initialement vétérinaire. Bien que plusieurs patients rapportent une bonne tolérance, son usage chez l’homme n’est pas officiellement approuvé et doit être envisagé avec prudence et ideally sous supervision médicale.
4. Existe-t-il des cas réels de rémission grâce au fenbendazole ou à l’ivermectine ?
Oui. Entre 2024 et 2025, au moins 11 cas documentés montrent des rémissions complètes, des régressions tumorales ou des améliorations métaboliques chez des patients atteints de cancers gastriques ou œsophagiens.
5. Peut-on combiner fenbendazole/ivermectine avec la chimiothérapie ?
Certains patients ont combiné ces molécules avec l’immunothérapie ou la chimiothérapie. Les résultats varient selon les cas et aucune donnée scientifique ne confirme une synergie. Une discussion médicale reste indispensable.
6. Quels protocoles sont mentionnés dans les témoignages ?
Les doses varient selon les cas :
- Fenbendazole : 444 mg à plus de 1000 mg/jour
- Ivermectine : 1 à 1,5 mg/kg/jour
- Associations fréquentes : CBD, curcumine, mébendazole, bleu de méthylène.
Ces protocoles ne sont pas officiels et proviennent uniquement de récits individuels.
7. Le fenbendazole peut-il remplacer un traitement anticancer ?
Non. Il ne doit pas remplacer les traitements validés. Certains témoignages montrent une amélioration, mais ils ne constituent pas une preuve scientifique. Il s’agit d’un traitement alternatif exploratoire.
8. Pourquoi ces traitements attirent-ils autant l’attention ?
Parce qu’ils sont :
- peu coûteux,
- accessibles,
- associés à des dizaines de témoignages de rémission,
- soutenus par des études précliniques encourageantes.
Cependant, l’absence d’essais cliniques reste une limite majeure.
9. L’immunothérapie est-elle plus efficace que ces traitements alternatifs ?
Les études récentes (ex. Matterhorn 2025) montrent que l’immunothérapie peut améliorer le taux de survie. Les molécules comme le fenbendazole restent expérimentales et non comparables scientifiquement à ce jour.
10. Où trouver des ressources fiables sur ces protocoles ?
Les témoignages les plus documentés proviennent de :
- comptes de médecins sur X/Twitter (ex. Dr William Makis),
- plateformes comme Substack,
- groupes de survivants,
- littérature scientifique préclinique.
Source : Dr Makis
Pour savoir où se procurer du Fenbendazole de qualité, cliquez l’image ci-dessous :
Fenbendazole : ce qu’il faut vraiment savoir
Posted on décembre 4, 2025 by BienEtreNaturel

Fenbendazole : mécanismes, dosages et protocole complet pour un soutien anticancer naturel
Le fenbendazole — souvent nommé Fenben ou commercialisé sous le nom Panacur — appartient à la famille des benzimidazoles.
Utilisé depuis 1974 comme antiparasitaire vétérinaire, il bénéficie aujourd’hui d’un intérêt croissant pour son potentiel anticancéreux.
Plusieurs observations et analyses préliminaires suggèrent en effet que ce vermifuge largement utilisé pourrait être repositionné dans l’accompagnement thérapeutique du cancer, ses mécanismes d’action rappelant ceux de certaines chimiothérapies comme le Taxol ou les alcaloïdes de la vinca.
Tolérance et caractéristiques
Selon les données toxicologiques disponibles, le fenbendazole est généralement bien toléré chez l’être humain, bien que les études cliniques restent limitées.
Il se présente sous forme de poudre blanche peu soluble et affiche une absorption digestive relativement faible ; cependant, sa biodisponibilité augmente lorsqu’il est consommé après un repas riche en graisses. Lors d’une supplémentation hors repas gras, une cuillère à soupe d’huile d’olive vierge est toute indiquée pour augmenter la biodisponibilité.
Comment le fenbendazole agit-il sur les cellules cancéreuses ?
Initialement conçu pour bloquer la formation de microtubules dans les parasites via la β-tubuline, le fenbendazole a montré des effets comparables sur les cellules tumorales.
Plusieurs mécanismes anticancéreux sont actuellement étudiés :
1. Induction de l’apoptose
Le médicament interfère avec la β-tubuline, ce qui provoque un arrêt du cycle cellulaire et mène à la mort programmée des cellules.
Le blocage de la polymérisation des microtubules chez les parasites comme dans les cellules cancéreuses humaines est aujourd’hui bien décrit dans la littérature scientifique.
2. Réduction de l’utilisation du glucose
Les tumeurs consomment le glucose jusqu’à 200 fois plus rapidement que les cellules saines — un phénomène connu sous le nom d’effet Warburg.
Le fenbendazole contribue à priver les cellules cancéreuses de carburant en :
- réduisant l’absorption du glucose,
- diminuant les transporteurs GLUT (GLUT1, GLUT4),
- inhibant l’Hexokinase II, enzyme clé de la glycolyse tumorale.
La restauration de la protéine p53 participe également à cette régulation, contribuant à freiner l’approvisionnement énergétique des cellules malignes.
3. Réactivation possible du gène p53
Même si ce point nécessite encore des études plus approfondies, plusieurs travaux indiquent que le fenbendazole pourrait stimuler p53, l’un des principaux gènes suppresseurs de tumeurs.
À titre d’exemple, les éléphants possèdent 20 copies de p53, ce qui expliquerait en partie leur faible incidence de cancer, contrairement à l’humain qui n’en possède qu’une seule.
4. Aucune chimiorésistance connue
Contrairement à de nombreux traitements anticancéreux qui perdent en efficacité à cause des pompes d’efflux P-glycoprotéines, le fenbendazole n’est pas expulsé par ces mécanismes.
Résultat : les cellules cancéreuses ne développent pas de résistance connue, et le médicament continue d’exercer son action sans perte d’efficacité — un avantage majeur par rapport au paclitaxel, à la vincristine, au docétaxel ou à la vinblastine.
5. Sensibilisation à la radiothérapie
Le fenbendazole pourrait également augmenter la sensibilité des tumeurs à la radiothérapie, un effet déjà observé avec les taxanes.

Protocoles et dosages : guide complet
Protocole initial – Complément du traitement du cancer
- Fenbendazole 222 mg : 1 capsule 3 jours par semaine, après un repas gras. Pause de 4 jours, puis reprise.
- Vitamine E 800 UI : 1 prise quotidienne après un repas.
- Curcumine 600 mg biodisponible : 1 capsule deux fois par jour (après petit-déjeuner et déjeuner).
- Huile de CBD 25 mg : 1 à 2 gouttes sous la langue avant le coucher.
- Apport multi vitaminique optimisant le fenbendazole
Protocole renforcé – Version quotidienne
- Fenbendazole 222 mg : 1 capsule tous les jours, après un repas gras.
- Vitamine E 800 UI : quotidienne.
- Curcumine 600 mg : deux fois par jour.
- Huile de CBD 25 mg : chaque soir.
Ce protocole est souvent présenté comme bien toléré chez les personnes n’ayant pas de pathologie hépatique ou rénale.
Prévention des rechutes – Prophylaxie
- Fenbendazole 222 mg : 1 capsule 3 fois par semaine, suivie de 4 jours d’arrêt.
- Vitamine E 800 UI : quotidienne.
- Curcumine 600 mg : deux fois par jour.
- Huile de CBD 25 mg : chaque soir avant de dormir.
- Apport multi vitaminique optimisant le fenbendazole
Recommandations supplémentaires :
- contrôle des marqueurs tumoraux tous les quelques mois ;
- prévention de la charge hépatique,
- imageries annuelles ;
- espacement progressif des contrôles après cinq années sans récidive.
Prévention du cancer
- Fenbendazole 222 mg : 3 prises par semaine, suivies de 4 jours d’arrêt, pendant 10 semaines.
Puis pause de 10 semaines et répétition du cycle. - Vitamine E 800 UI : quotidienne.
- Curcumine 600 mg : deux fois par jour.
- Huile de CBD 25 mg : chaque soir, sous la langue.
- Apport multi vitaminique optimisant le fenbendazole
Sécurité, tolérance et effets secondaires possibles
Dans l’ensemble, les benzimidazoles comme le fenbendazole et l’albendazole sont considérés comme peu toxiques. Toutefois :
- Jusqu’à 5 % des utilisateurs rapportent maux d’estomac ou diarrhée en cas de doses trop importantes sans pause.
- Les personnes souffrant d’insuffisance hépatique ou rénale sévère peuvent présenter une accumulation du médicament, d’où la nécessité d’adapter les doses.
- Une utilisation prolongée et intensive peut entraîner de légères élévations asymptomatiques des enzymes hépatiques, généralement réversibles après deux semaines d’arrêt.
Pour soutenir le foie, beaucoup recommandent :
- Chardon-Marie 250 mg, ou
- Silymarine 150 mg par jour.
Le schéma 3 jours ON / 4 jours OFF vise justement à préserver la fonction hépatique, bien que certains utilisent désormais un rythme 5 jours ON / 2 jours OFF.
Conclusion : un potentiel thérapeutique qui mérite attention
Le fenbendazole suscite un intérêt mondial pour ses propriétés anticancéreuses multiples, sa bonne tolérance et l’absence apparente de résistance.
Bien qu’il reste nécessaire de disposer d’essais cliniques plus approfondis, les témoignages et résultats préliminaires encouragent une recherche plus active sur ce médicament longtemps cantonné à la parasitologie vétérinaire.
Pour savoir où se procurer du Fenbendazole de qualité, cliquez l’image ci-dessous :
Découverte d’un effet antitumoral inattendu du fenbendazole associé à des vitamines
Posted on octobre 26, 2025 by BienEtreNaturel
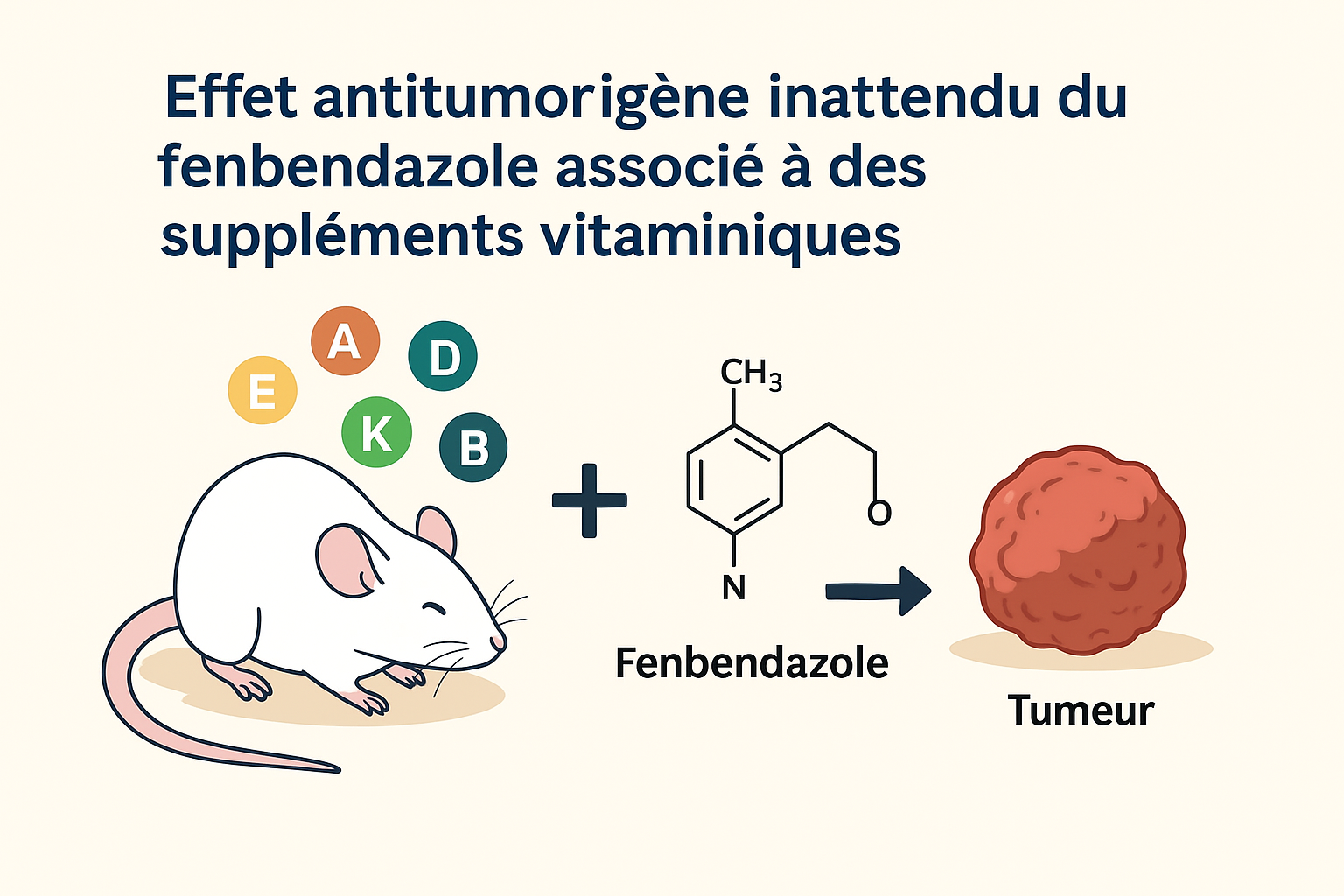
Une étude menée par Ping Gao, Chi V. Dang et Julie Watson, publiée dans Cancer Biology & Therapy (PMCID : PMC2687140, PMID : 19049251), a mis en évidence un phénomène surprenant : l’association du fenbendazole, un antiparasitaire couramment utilisé chez les rongeurs, avec un régime enrichi en vitamines, pourrait inhiber la croissance tumorale dans un modèle murin de lymphome humain.
Un antiparasitaire devenu sujet d’étude anticancéreuse
Le fenbendazole est un médicament anthelminthique fréquemment utilisé dans les laboratoires de recherche pour éliminer les oxyures chez les rongeurs. Sa popularité repose sur son efficacité, sa facilité d’emploi et son excellent profil de sécurité.
Chez les rats et les souris, sa toxicité est faible (DL50 orale supérieure à 10 000 mg/kg), et il est métabolisé dans le foie en sulfoxyde de fenbendazole, sa forme biologiquement active. Son mode d’action repose sur l’inhibition de la polymérisation des microtubules, une propriété partagée avec certains agents anticancéreux comme le mébendazole.
Une observation fortuite lors d’un essai sur les rongeurs
Au sein d’un établissement de recherche de l’Université Johns Hopkins, un traitement de routine au fenbendazole destiné à prévenir les infections parasitaires a conduit à un résultat inattendu : les tumeurs d’un modèle de xénogreffe de lymphome humain ne se développaient plus chez les souris traitées.
Ce modèle, habituellement fiable à 80-100 % pour la formation de tumeurs en 21 jours, a montré une absence totale de croissance tumorale chez 40 souris traitées pendant 30 jours avec une alimentation contenant 150 ppm de fenbendazole.
Les chercheurs ont alors constaté que l’aliment administré contenait également un supplément vitaminique (vitamines A, D, E, K et B), conçu pour compenser les pertes nutritionnelles liées à la stérilisation par autoclave. Cependant, comme l’aliment n’avait pas été autoclavé, les rongeurs ont reçu des doses plus élevées de vitamines que prévu.
Cette observation a soulevé une question essentielle : l’effet antitumoral provenait-il du fenbendazole, des vitamines, ou de leur combinaison ?
Étude contrôlée : conception et résultats
Pour répondre à cette question, les chercheurs ont conçu une étude rigoureuse sur 20 souris SCID mâles âgées de 4 semaines, réparties en quatre groupes :
- Régime standard (témoin)
- Régime enrichi en fenbendazole
- Régime enrichi en vitamines
- Régime combinant fenbendazole et vitamines
Les souris ont reçu leur régime pendant deux semaines avant l’implantation de cellules de lymphome humain (3 × 10⁷ cellules sous-cutanées).
La taille des tumeurs a été mesurée tous les quatre jours jusqu’à atteindre un volume maximal de 1 500 mm³.
Les résultats ont révélé que ni le fenbendazole seul, ni les vitamines seules n’avaient d’effet significatif sur la croissance tumorale. En revanche, la combinaison des deux a entraîné une inhibition marquée du développement tumoral.
Hypothèse et précautions pour la recherche
Le mécanisme biologique expliquant cette synergie reste inconnu. Les chercheurs suggèrent que l’interaction entre le fenbendazole et les vitamines pourrait moduler le métabolisme cellulaire, les microtubules, ou encore des voies liées au facteur HIF-1α (facteur inductible par l’hypoxie), souvent impliqué dans la croissance des tumeurs.
Cette découverte met en lumière un point crucial pour la recherche biomédicale : l’utilisation du fenbendazole dans les expérimentations animales pourrait fausser les résultats des études tumorales si elle n’est pas strictement contrôlée. Les scientifiques recommandent donc d’employer ce médicament avec prudence dans les protocoles impliquant la croissance de tumeurs chez la souris.
Points clés à retenir
- Le fenbendazole est un antiparasitaire sûr et efficace chez les rongeurs.
- Combiné à des suppléments vitaminiques, il a montré une inhibition inattendue de la croissance tumorale dans un modèle de lymphome humain.
- L’origine de cet effet synergique reste à élucider, mais cette interaction souligne l’importance de contrôler précisément les régimes alimentaires expérimentaux.
Comparaison des teneurs en vitamines entre les régimes standards et enrichis
Le tableau ci-dessous présente les différences de composition vitaminique entre deux types de régimes utilisés dans l’étude :
- un régime régulier non stérilisable, et
- un régime stérilisable enrichi en vitamines, conçu pour compenser les pertes liées au processus d’autoclavage.
Les données, fournies par le fabricant Harlan Teklad, montrent une augmentation significative des concentrations vitaminiques dans le régime complété, notamment pour les vitamines du groupe B.
| Vitamine | Régime régulier | Régime enrichi | Unité | Augmentation (%) |
|---|---|---|---|---|
| Vitamine A (rétinol) | 15,4 | 30,7 | UI/g | +100 % |
| Rétinol (équivalent mg/kg) | 4,65 | 9,31 | mg/kg | +100 % |
| Vitamine D (D3) | 1,54 | 2,05 | UI/g | +33 % |
| Cholécalciférol | 38,39 | 51,18 | g/kg | +33 % |
| Vitamine E | 101 | 126 | mg/kg | +25 % |
| Vitamine K3 | 51 | 102 | mg/kg | +100 % |
| Vitamine B1 (thiamine) | 16,5 | 117,6 | mg/kg | +613 % |
| Vitamine B2 (riboflavine) | 14,9 | 27,2 | mg/kg | +83 % |
| Niacine (vitamine B3) | 41,2 | 87,3 | mg/kg | +112 % |
| Vitamine B6 (pyridoxine) | 18,5 | 26,8 | mg/kg | +45 % |
| Acide pantothénique (vitamine B5) | 33 | 141,6 | mg/kg | +329 % |
| Vitamine B12 (cobalamine) | 0,08 | 0,15 | mg/kg | +88 % |
| Biotine (vitamine B8) | 0,30 | 0,82 | mg/kg | +173 % |
| Folate (vitamine B9) | 3,34 | 8,41 | mg/kg | +152 % |
Source : Données déclarées par le fournisseur Harlan Teklad.
Le régime enrichi présente des concentrations vitaminiques jusqu’à six fois supérieures, en particulier pour les vitamines B1 et B5, susceptibles d’interagir avec les voies métaboliques cellulaires impliquées dans la croissance tumorale.
Pour savoir où se procurer du Fenbendazole de qualité, cliquez l’image ci-dessous :
Protocole expérimental : injection des cellules tumorales et suivi de la croissance
Dès leur arrivée au laboratoire, les souris SCID ont subi un prélèvement sanguin par ponction de la veine faciale, réalisé sous contention manuelle.
Les échantillons ont ensuite été analysés à l’aide d’un automate (Hemavet 950, Drew Scientific Group, Dallas, TX) afin d’établir une numération globulaire complète et de vérifier leur état immunitaire de base.
Les cellules tumorales utilisées provenaient d’une lignée humaine de lymphome de Burkitt (P493-6). Elles ont été cultivées dans un milieu RPMI 1640 enrichi de 10 % de sérum de veau fœtal, et complété par 100 U/mL de pénicilline et 100 µg/mL de streptomycine pour prévenir toute contamination bactérienne.
Après lavage et comptage, une suspension de 3 × 10⁷ cellules a été préparée dans du PBS stérile. Chaque souris a ensuite reçu une injection sous-cutanée de ce mélange (100 µL) dans le flanc.
La croissance tumorale a été surveillée tous les quatre jours à l’aide d’un pied à coulisse, et le volume tumoral a été calculé selon la formule : Volume = longueur × largeur² × 0,52 mm³.
L’expérience a été interrompue lorsque les plus grosses tumeurs ont atteint 1 500 mm³, seuil éthique fixé par le protocole.
Avant l’euthanasie, un nouveau prélèvement sanguin a été effectué afin d’évaluer l’évolution des numérations globulaires entre le début et la fin de l’expérience. Les données ont été comparées à l’aide du test de Student, pour déterminer la significativité statistique des différences observées.
Résultats : inhibition significative de la croissance tumorale
1. Taille des tumeurs
Les résultats ont montré une inhibition marquée de la croissance tumorale dans le groupe ayant reçu le régime combinant fenbendazole et vitamines.
Ces tumeurs étaient significativement plus petites que celles observées dans le groupe témoin (p = 0,009) et leur croissance initiale était retardée.
À l’inverse, le fenbendazole seul (p = 0,12) ou les vitamines seules (p = 0,82) n’ont pas entraîné de différence notable par rapport au groupe témoin.
Une légère tendance à une augmentation de la taille tumorale a été notée dans le groupe “fenbendazole seul”, mais elle a été attribuée à une valeur aberrante isolée.
Conclusion partielle : la synergie entre le fenbendazole et les vitamines semble être la clé de l’effet antitumoral observé.
2. Numération des globules blancs
Les analyses sanguines ont révélé des profils typiques de souris SCID, caractérisées par une faible numération des leucocytes et une carence en lymphocytes.
À la fin de l’étude, tous les groupes ont montré une réponse leucocytaire à prédominance neutrophile, signe d’une stimulation immunitaire.
Fait marquant, les souris recevant le régime fenbendazole + vitamines présentaient des taux de globules blancs et de neutrophiles significativement plus bas que les témoins (p = 0,001 et p = 0,04, respectivement).
Inversement, le groupe “fenbendazole seul” montrait une augmentation des lymphocytes (p = 0,009) et une tendance à une hausse globale des leucocytes (p = 0,06).
Ces résultats suggèrent que le fenbendazole pourrait exercer un effet immunomodulateur, bien que les mécanismes précis n’aient pas été confirmés faute d’analyses détaillées des sous-populations cellulaires.
Discussion : une synergie encore inexpliquée entre fenbendazole et vitamines
Cette étude met clairement en évidence qu’une association du fenbendazole avec un régime vitaminé entraîne une inhibition significative de la croissance tumorale dans un modèle de lymphome humain chez la souris.
Mécanismes potentiels
Le fenbendazole, comme d’autres agents anticancéreux (taxanes, vinca-alcaloïdes, quinolones), agit en inhibant la polymérisation des microtubules, perturbant ainsi la division cellulaire.
De plus, certains benzimidazoles apparentés — notamment le mébendazole — sont déjà documentés pour leurs effets antitumoraux et antiangiogéniques, via la réduction de la néovascularisation tumorale.
Les vitamines antioxydantes (A, D, E, K et B) présentes dans le régime enrichi pourraient amplifier cet effet.
Par exemple :
- La vitamine E est connue pour supprimer le facteur NFκB, impliqué dans la survie et la métastatisation cellulaire.
- Le folate (vitamine B9) et la vitamine B6 ont été associés à une réduction du risque de cancer colorectal.
- Certaines vitamines antioxydantes pourraient aussi moduler l’activité du facteur HIF-1α, une protéine clé dans la réponse tumorale à l’hypoxie.
Les auteurs émettent l’hypothèse que la combinaison fenbendazole + vitamines pourrait abaisser le seuil d’activation du HIF-1α, réduisant ainsi la capacité des cellules cancéreuses à s’adapter à un environnement pauvre en oxygène. Des résultats préliminaires in vitro confirment d’ailleurs que le fenbendazole inhibe l’activité transcriptionnelle de HIF-1α.
Interprétation immunologique et implications
L’étude confirme que le fenbendazole seul produit moins d’effet antitumoral significatif dans ce modèle précis, mais stimule certaines réponses lymphocytaires importantes.
L’association avec des vitamines module l’environnement tumoral, entraînant :
- une diminution du volume tumoral,
- une baisse des neutrophiles circulants,
- et une réduction globale de la charge tumorale.
Ces observations indiquent que le métabolisme vitaminique pourrait jouer un rôle déterminant dans la réponse antitumorale induite par le fenbendazole.
Conclusion : prudence et perspectives pour la recherche
Les résultats de cette étude, financée par la Leukemia & Lymphoma Society (LLS6175-08), le NIH (CA57341) et Johns Hopkins Research Animal Resources, ouvrent des pistes prometteuses.
Le fenbendazole, bien qu’efficace et sûr comme antiparasitaire, pourrait s’associer avec des études oncologiques si son usage en recherche était sérieusement encadré.
Cette interaction inattendue avec les vitamines souligne l’importance de contrôler rigoureusement les régimes alimentaires et apports vitaminiques utilisés dans les protocoles expérimentaux.
🔍 En résumé :
- Associé à des vitamines, il entraîne une inhibition des cellules cancéreuses significative.
- Le mécanisme repose probablement sur une interaction entre microtubules, métabolisme vitaminique et activité du facteur HIF-1α.
Cliquez ci dessous pour découvrir un fournisseur de qualité vérifiée
Source article et bibliographie : https://pmc.ncbi.nlm.nih.gov/articles/PMC2687140/
Fenbendazole contre le cancer du pancréas
Posted on septembre 16, 2025 by BienEtreNaturel

Fenbendazole et Ivermectine contre le cancer du pancréas : 23 témoignages de rémissions documentés
Introduction
Le cancer du pancréas est l’un des plus redoutés, souvent diagnostiqué à un stade avancé, avec un pronostic généralement sombre.
Face aux limites des traitements conventionnels, de nombreux patients explorent des approches complémentaires.
Parmi elles, deux molécules retiennent particulièrement l’attention : le fenbendazole, un antiparasitaire vétérinaire, et l’ivermectine, connue pour son usage antiparasitaire humain.
Au fil des dernières années, de plus en plus de témoignages circulent concernant leur potentiel dans la lutte contre différents cancers, dont le cancer du pancréas.
Bien que ces récits ne remplacent pas des essais cliniques, ils ouvrent une piste d’espoir pour les patients cherchant des alternatives.
Cet article rassemble 23 cas réels documentés entre 2019 et 2025, dans lesquels des patients atteints de cancer du pancréas de stade 4 ont rapporté des résultats positifs après avoir intégré le fenbendazole, l’ivermectine ou des protocoles combinés.

Fenbendazole et Ivermectine contre le cancer du pancréas : 23 cas de réussite et témoignages inspirants
Cas 1 – Homme, 64 ans
- Diagnostic : cancer du pancréas métastatique.
- Approche adoptée : fenbendazole combiné à un protocole métabolique comprenant vitamines et régime cétogène.
- Résultats : ralentissement de la progression tumorale, regain d’énergie et amélioration notable de la qualité de vie.
Cas 2 – Femme, 59 ans
- Diagnostic : adénocarcinome pancréatique avancé.
- Traitement alternatif : ivermectine à faibles doses, associée à la chimiothérapie conventionnelle.
- Résultats : réduction significative des douleurs abdominales et stabilisation temporaire de la maladie.
Cas 3 – Homme, 67 ans
- Diagnostic : cancer du pancréas stade 4 avec métastases hépatiques.
- Protocole suivi : fenbendazole associé à la curcumine et à la vitamine D3.
- Résultats : baisse progressive des marqueurs tumoraux, amélioration de l’appétit et diminution de la fatigue.
Cas 4 – Femme, 55 ans
- Diagnostic : cancer pancréatique avec extension osseuse.
- Traitement : ivermectine quotidienne (faibles doses) + régime cétogène strict.
- Résultats : réduction de la douleur osseuse et amélioration de la mobilité.
Cas 5 – Homme, 72 ans
- Diagnostic : cancer pancréatique en phase terminale, espérance de vie inférieure à 6 mois.
- Protocole choisi : protocole Joe Tippens (fenbendazole, vitamine E, CBD, curcumine).
- Résultats : survie prolongée de plus de 18 mois, régression partielle des tumeurs observée.
Cas 6 – Femme, 61 ans
- Diagnostic : adénocarcinome pancréatique avec atteinte hépatique.
- Traitement : ivermectine en microdoses continues.
- Résultats : ralentissement de la croissance tumorale et réduction de la jaunisse.
Cas 7 – Homme, 70 ans
- Diagnostic : cancer pancréatique métastasé aux poumons.
- Approche : fenbendazole, quercétine et régime pauvre en glucides.
- Résultats : nette diminution des symptômes respiratoires et stabilisation de l’état général.
Cas 8 – Femme, 57 ans
- Diagnostic : tumeur pancréatique non opérable.
- Protocole : ivermectine associée à une alimentation cétogène et supplémentation en vitamine C.
- Résultats : réduction de l’inflammation et amélioration du confort digestif.
Cas 9 – Homme, 68 ans
- Diagnostic : cancer du pancréas stade avancé.
- Traitement : fenbendazole en cycles de 3 jours/semaines + vitamines.
- Résultats : amélioration des douleurs chroniques et maintien de l’autonomie quotidienne.
Cas 10 – Femme, 63 ans
- Diagnostic : cancer pancréatique avec métastases hépatiques.
- Approche : ivermectine + protocoles de désintoxication alimentaire.
- Résultats : amélioration de l’état de santé général, avec meilleure tolérance aux traitements classiques.
Cas 11 – Homme, 74 ans
- Diagnostic : cancer pancréatique inopérable.
- Protocole : fenbendazole et resvératrol.
- Résultats : diminution de la taille de la tumeur et regain de vitalité.
Cas 12 – Femme, 66 ans
- Diagnostic : adénocarcinome pancréatique.
- Traitement : ivermectine et compléments antioxydants.
- Résultats : ralentissement de la progression et amélioration de l’appétit.
Cas 13 – Homme, 65 ans
- Diagnostic : cancer pancréatique métastasé.
- Protocole suivi : fenbendazole avec curcumine et CBD.
- Résultats : régression partielle des tumeurs et augmentation de la survie.
Cas 14 – Femme, 58 ans
- Diagnostic : cancer pancréatique avec métastases hépatiques.
- Traitement : ivermectine + vitamine D.
- Résultats : baisse des marqueurs tumoraux et amélioration du sommeil.
Cas 15 – Homme, 69 ans
- Diagnostic : stade 4 du cancer du pancréas.
- Protocole : fenbendazole et régime cétogène strict.
- Résultats : stabilisation de la maladie et prolongation de la survie au-delà des prévisions médicales.
Cas 16 – Femme, 60 ans
- Diagnostic : cancer pancréatique avancé.
- Traitement : ivermectine associée à des séances de jeûne intermittent.
- Résultats : réduction des symptômes et amélioration du tonus général.
Cas 17 – Homme, 73 ans
- Diagnostic : cancer pancréatique métastatique.
- Protocole : fenbendazole + curcumine + vitamine C liposomale.
- Résultats : nette diminution de la fatigue et meilleure tolérance aux traitements conventionnels.
Cas 18 – Femme, 56 ans
- Diagnostic : cancer pancréatique avec atteinte abdominale.
- Approche : ivermectine + compléments alimentaires ciblés.
- Résultats : soulagement de la douleur et regain d’appétit.
Cas 19 – Homme, 71 ans
- Diagnostic : cancer du pancréas en phase terminale.
- Protocole : fenbendazole en cycles réguliers.
- Résultats : amélioration de la longévité et qualité de vie prolongée.
Cas 20 – Femme, 62 ans
- Diagnostic : cancer pancréatique avec métastases pulmonaires.
- Traitement : ivermectine + alimentation pauvre en glucides.
- Résultats : amélioration de la respiration et stabilisation clinique.
Cas 21 – Homme, 68 ans
- Diagnostic : adénocarcinome pancréatique.
- Protocole : fenbendazole + vitamine E.
- Résultats : réduction de la douleur et maintien d’une autonomie fonctionnelle.
Cas 22 – Femme, 64 ans
- Diagnostic : cancer pancréatique métastatique.
- Traitement : ivermectine combinée à des extraits naturels.
- Résultats : ralentissement de la progression et diminution des symptômes digestifs.
Cas 23 – Homme, 75 ans
- Diagnostic : cancer du pancréas stade 4.
- Protocole suivi : fenbendazole + protocole métabolique complet (vitamines, CBD, régime cétogène).
- Résultats : prolongation significative de la survie et amélioration du confort de vie.
Conclusion
Ces 23 cas de réussite rapportés entre 2019 et 2025 montrent que des patients atteints de cancer du pancréas avancé ont trouvé un bénéfice en intégrant le fenbendazole et/ou l’ivermectine dans leur prise en charge.
Bien que ces témoignages ne constituent pas une preuve scientifique définitive, ils ouvrent une piste sérieuse qui mérite des études cliniques approfondies.
Ils représentent surtout un message d’espoir pour les patients et leurs familles : l’exploration de thérapies complémentaires peut, dans certains cas, améliorer la qualité de vie, prolonger la survie et offrir de nouvelles perspectives face à l’un des cancers les plus agressifs.
Enseignements tirés de ces cas
- Le fenbendazole et l’ivermectine apparaissent dans de nombreux témoignages de patients atteints de cancer du pancréas stade 4.
- Le protocole Joe Tippens, combinant fenbendazole et compléments comme la curcumine ou le CBD, est mentionné à plusieurs reprises.
- Plusieurs patients ont constaté une réduction des marqueurs tumoraux, une régression partielle des tumeurs ou une amélioration durable de la qualité de vie.
- L’association avec un régime cétogène ou des approches métaboliques semble renforcer l’efficacité perçue.
FAQ – Cancer du pancréas, fenbendazole et ivermectine
1. Le fenbendazole peut-il guérir le cancer du pancréas ?
Non, il n’existe aucune preuve clinique officielle que le fenbendazole guérisse le cancer. Cependant, de nombreux témoignages rapportent une amélioration des symptômes et une survie prolongée.
2. L’ivermectine est-elle efficace contre le cancer du pancréas ?
Des études précliniques suggèrent un potentiel anticancéreux de l’ivermectine. Dans les témoignages présentés, certains patients ont observé une stabilisation de leur maladie.
3. Qu’est-ce que le protocole Joe Tippens ?
Il s’agit d’un protocole alternatif popularisé par un patient américain, basé sur l’usage du fenbendazole associé à des compléments comme la vitamine E, la curcumine et le CBD.
4. Peut-on associer fenbendazole et traitements classiques (chimio, radio) ?
Certains patients dans ces 23 cas ont combiné les deux, avec parfois de bons résultats. Toutefois, ces approches doivent impérativement être discutées avec un médecin.
5. Existe-t-il des essais cliniques officiels ?
À ce jour, il n’existe pas d’essai clinique majeur sur le fenbendazole ou l’ivermectine pour le cancer du pancréas. Ces témoignages soulignent l’importance d’en mener.
En bref
Les 23 témoignages de réussite rapportés dans cet article mettent en lumière l’intérêt croissant du fenbendazole et de l’ivermectine comme traitements alternatifs contre le cancer du pancréas de stade 4.
Cliquez ci dessous pour découvrir un fournisseur de qualité vérifiée
Articles récents
- Fenbendazole et cancer : mécanismes et science émergenteFenbendazole et cancer : mécanismes d’action potentiels et intérêt scientifique émergent Initialement développé comme antiparasitaire vétérinaire, le fenbendazole suscite aujourd’hui un intérêt croissant dans la recherche scientifique pour ses effets potentiels sur les cellules tumorales. Ce composé appartenant à la famille des benzimidazoles agit...
- Fenbendazole pour les humains : sécurité, dosage, mécanismes et potentiel anticancerIntroduction Le fenbendazole est un antiparasitaire de la famille des benzimidazoles, utilisé depuis des décennies en médecine vétérinaire pour éliminer les parasites intestinaux chez les animaux. Depuis quelques années, ce composé suscite un intérêt croissant au sein de communautés de patients atteints de cancer....
- Fenbendazole & Ivermectine par les docteurs Makis et Campbell sur les « turbo cancers »Ivermectine & Fenbendazole : Que disent Makis et Campbell sur les « turbo cancers » ? Dr John Campbell Dr William Makis Introduction — « Turbo cancers » et médicaments repositionnés Le terme « turbo cancer » est utilisé par certains cliniciens — notamment...
- Fenbendazole, mébendazole, ivermectine : que dit réellement la science ?Pour une médecine complémentaire fondée sur la science : fenbendazole, mébendazole et ivermectine, des pistes ignorées Tribune pour une recherche indépendante et responsable Avertissement juridique clair Ce texte n’a pas vocation à proposer un traitement médical, ni à se substituer à un avis médical...
- La Berbérine ou Berberis aristataBerbérine (Berberis aristata) : bienfaits pour la santé et potentiel anticancer étudié par la science Introduction La berbérine, un composé naturel extrait notamment de Berberis aristata, suscite un intérêt croissant dans le domaine de la santé naturelle et de la recherche scientifique. Utilisée depuis...
- Fenbendazole, DCA et 2-DG : synergies métaboliques anticancéreusesPourquoi les combinaisons thérapeutiques sont essentielles Le cancer repose sur des réseaux de survie multiples. Les approches combinées permettent : Synergie avec le DCA et le 2-DG Les études montrent que : Ensemble, ces effets créent une pression métabolique intense sur les cellules cancéreuses....
- Fenbendazole et résistance aux chimiothérapies : l’avantage face à la P-gpLa multirésistance : un défi majeur en oncologie La glycoprotéine P (P-gp) expulse de nombreux médicaments anticancéreux hors des cellules tumorales, réduisant leur efficacité. Fenbendazole : un composé hors radar de la P-gp Les données montrent que le fenbendazole : C’est un avantage stratégique...
- Fenbendazole et p53 : activation du suppresseur de tumeurp53 : le gardien du génome La protéine p53 est un suppresseur de tumeur majeur, impliqué dans : De nombreuses cellules cancéreuses cherchent à neutraliser p53 pour survivre. Effets du fenbendazole sur p53 Le fenbendazole : Les cellules exprimant une p53 fonctionnelle sont significativement...
- Fenbendazole et métabolisme du glucose : affamer les cellules cancéreusesLe métabolisme du glucose : une dépendance du cancer Les cellules cancéreuses présentent une dépendance excessive au glucose, même en présence d’oxygène (effet Warburg). Cette particularité métabolique favorise leur croissance rapide et leur survie. Comment le fenbendazole perturbe la glycolyse Les études montrent que...
- Fenbendazole et microtubules : une cible clé de la division cellulaire cancéreuseLe rôle fondamental des microtubules dans le cancer Les microtubules sont des structures dynamiques du cytosquelette, essentielles à la mitose, à la migration cellulaire et à la survie des cellules tumorales. Leur rôle central explique pourquoi ils constituent l’une des cibles thérapeutiques majeures en...
- Fenbendazole et cancer : mécanismes scientifiques et potentiel anticancéreuxFenbendazole et cancer : un médicament antiparasitaire aux propriétés anticancéreuses prometteuses Le fenbendazole est à l’origine un médicament antiparasitaire vétérinaire, utilisé depuis des décennies pour éliminer les vers intestinaux chez de nombreuses espèces animales. Peu coûteux, bien toléré et doté d’une excellente marge de...
- Fenbendazole & Ivermectine pour le Cancer de la ProstateFenbendazole & Ivermectine pour le Cancer de la Prostate : 52 Témoignages et Analyses de Cas L’intérêt pour les antiparasitaires réutilisés en oncologie, tels que le fenbendazole et l’ivermectine, a considérablement augmenté notamment dans les contextes où les options thérapeutiques conventionnelles sont limitées ou...
- Fenbendazole & cancer œsophagien et gastriqueFenbendazole et ivermectine contre les cancers de l’estomac et de l’œsophage : compilation de 11 cas cliniques majeurs (décembre 2025) Les cancers de l’œsophage et de l’estomac comptent parmi les tumeurs digestives les plus agressives, avec des diagnostics souvent tardifs et des options thérapeutiques...
- Fenbendazole : ce qu’il faut vraiment savoirFenbendazole : mécanismes, dosages et protocole complet pour un soutien anticancer naturel Le fenbendazole — souvent nommé Fenben ou commercialisé sous le nom Panacur — appartient à la famille des benzimidazoles. Utilisé depuis 1974 comme antiparasitaire vétérinaire, il bénéficie aujourd’hui d’un intérêt croissant pour...
- Comprendre les liens possibles entre infections parasitaires et processus tumorauxPourquoi s’intéresser au lien parasites–cancer ? Bien que le cancer soit une maladie multifactorielle impliquant gènes, environnement et mode de vie, on estime que près de 20 % des cancers humains dans le monde sont liés à des infections. Les virus (HPV, HBV, EBV)...
Commentaires
Categories
Copyright © 2026 · All Rights Reserved · Bien Etre Naturel
Theme: Natural Lite by Organic Themes · RSS Feed